《生物设计与制造(英文)》(英文名Bio-Design & Manufacturing)是由浙江大学主办,依托浙江大学机械工程学院相关学科团队,于2018年正式创刊的一本专业学术期刊,创刊当年即被Scopus收录,今年获得了首个CiteScore值为2.6;刊物2019年12月被SCI-E数据库正式收录,因此在今年公布的JCR报告中,也获得了首个影响因子,为4.095。
与同类型期刊相比,本刊被归在ENGINEERING, BIOMEDICAL分库,在该分类的87本SCI收录期刊中列第17位,在Q1区内。

据日前BDM的发展趋势,它所聚焦的领域交叉生物科技、物质科学、信息科技、工程科学和设计与制造技术交叉融合,正在产生颠覆性科技和多学科交叉前沿,故BDM将与学科共蠃,推动科技和社会的进步,2021年的国际影响力有望持续上升(理论上今年6月份公布的IF,将不会低于5分)。
投稿网址
期刊网址:
https://www.springer.com/journal/42242/
http://www.jzus.zju.edu.cn/(国内可下载全文)
投稿地址:
https://www.editorialmanager.com/bdmj/default.aspx
或点击“阅读原文”
文章前言
尽管2020年全球正遭受着新型冠状病毒肺炎(COVID-19)疫情的影响,但生物设计与制造(BDM)的发展并未停止。我们挑选了2020年中在这个蓬勃发展的领域里最令人振奋的进展,从包括肾脏在内的不同功能性微型类器官的三维(3D)生物打印,到无穷宇宙中3D组织的制造,也有领域内出现的包括无创体内3D生物打印、活体3D生物打印、单细胞打印和快速成型等显著技术性突破,还有包括人血脑屏障平台、2型糖尿病(T2D)的无创治疗和海绵体重建等重大生物医学应用,进一步造福了医疗发展和我们的整体生活质量。
作者:
马梁,浙江大学
引用本文:
Liang Ma, Industry news: 2020 high-impact publications in the BDM area, Bio-des. Manuf., 2021. https://doi.org/10.1007/s42242-020-00123-2
全文链接(可点击直接下载PDF)
https://link.springer.com/article/10.1007/s42242-020-00123-2#citeas
1. Nature Communications: 用于研究纳米颗粒运输机制的微工程人血脑屏障平台
佐治亚理工学院的YongTae Kim教授团队在Nature Communications杂志上发表的题为“Microengineered human blood-brain barrier platform for understanding nanoparticle transport mechanisms”的文章,为我们展示了一个微生理平台,构建了人血脑屏障的关键结构和功能,并能够对血管和血管周围区域的纳米颗粒分布进行3D映射。该模型精确捕获了3D纳米颗粒在细胞水平上的分布,并通过受体介导的胞吞作用展示了独特的细胞摄取和血脑屏障(BBB)渗透现象。此血脑屏障平台还可作为动物模型的体外补充模型,用于预先筛选候选药物来治疗神经系统疾病。
https://doi.org/10.1038/s41467-019-13896-7
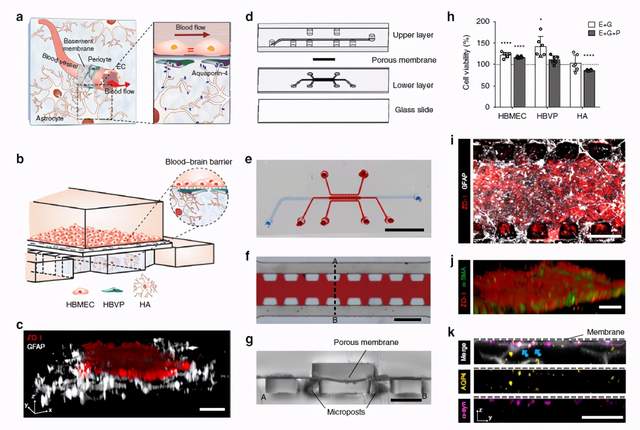
微工程人血脑屏障(BBB)模型
a BBB示意图 b 微工程人BBB模型示意图 c BBB模型的3D结构 d 装置的爆炸视图 e 制造完成的装置图片 f 下层由三个平行的通道组成,这些通道由一系列的微柱隔开 g 装置的横截面 h 评估细胞代谢活动 i 装置的底视图 j 由一层人脑血管周细胞支撑的内皮单层 k 下通道多孔膜下方星形胶质细胞终末脚上AQP4和α-syn的表达
2. Cell Metabolism: 暴露于静磁场和静电场可治疗2型糖尿病
来自爱荷华大学Carter和Huang等人在Cell Metabolism上发表题为“Exposure to static magnetic and electric fields treats type 2 diabetes”的文章,该研究表明了一种显着的氧化还原调节现象,该现象利用内源性电磁受体机制对T2D以及其他潜在的与氧化还原相关的疾病进行无创治疗。该项研究结合了静态磁场与电场增强了胰岛素的敏感性,且无任何副作用,可以引发系统的氧化还原来控制胰岛素的灵敏度,同时在肝脏线粒体超氧化物清除过程中可消除其作用。
https://doi.org/10.1016/j.cmet.2020.09.012
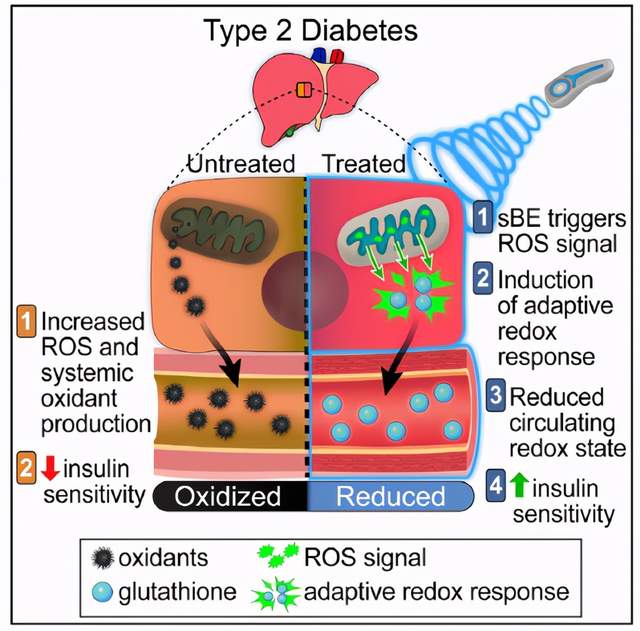
研究概要示意图
3. Nature Materials: 细胞挤出式生物打印可改善肾脏类器官的再现性和构象
来自澳洲墨尔本大学的Melissa H. Little团队在Nature Materials杂志上发表了题为“Cellular extrusion bioprinting improves kidney organoid reproducibility and conformation”的文章。在这项研究中,作者们应用了挤出式3D细胞生物打印技术,以快速、高通量地形成肾脏类器官,并具有高度可重复的细胞数量和活性。用于肾脏类器官构建的自动化挤出式生物打印可提高通量、质量控制、规模和结构,从而促进干细胞来源的人肾脏组织的体外和体内应用。
https://doi.org/10.1038/s41563-020-00853-9

生物打印类器官在96孔板化合物测试中的应用
4. Nature Materials: 通过类器官生物打印实现大尺寸组织构建
瑞士洛桑联邦理工学院Matthias P. Lutolf研究团队在Nature Materials上发表文章 “Recapitulating macro-scale tissue self-organization through organoid bioprinting”,此研究介绍了使用形成类器官的干细胞作为构建基块,可以直接沉积到有助于自发自组织的细胞外基质中的3D生物打印概念。这项研究显示了如何将生物制造和类器官技术结合以控制毫米到厘米范围内的组织自组织过程,为药物发现、诊断和再生医学开辟了新途径。
https://doi.org/10.1038/s41563-020-00803-5
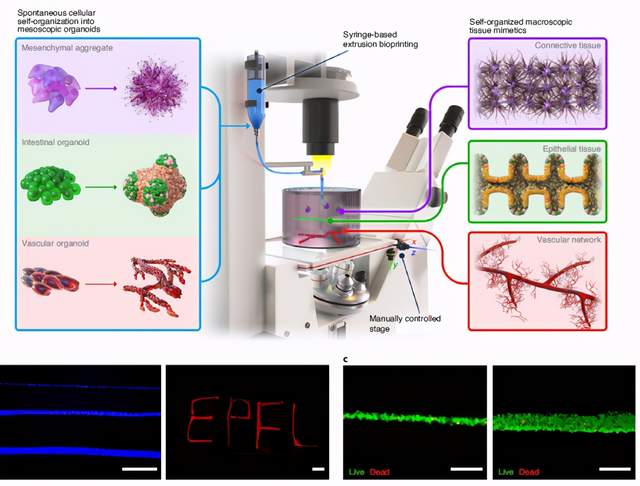
使用自发自组织的构建基块来构建大尺寸组织的BATE概念示意图及打印效果
5. Science Advances: 太空中3D组织结构的磁悬浮生物组装
3D Bioprinting Solutions 公司生物技术研究实验室的Vladimir A. Mironov 教授等领导团队在Science Advances 期刊上发表了“Magnetic levitational bioassembly of 3D tissue construct in space”的文章。这项研究首次在太空中在微重力作用下将由人类软骨细胞组成的组织球体生物制造成为3D组织结构。研究数据有力地表明,使用磁场进行无支架生物成型制造是传统的基于支架方法的可行替代方案,暗示着可显着促进组织工程发展的新研究途径。太空中的磁悬浮生物组装还可以推进太空生命科学和太空再生医学的发展。
https://doi.org/10.1126/sciadv.aba4174
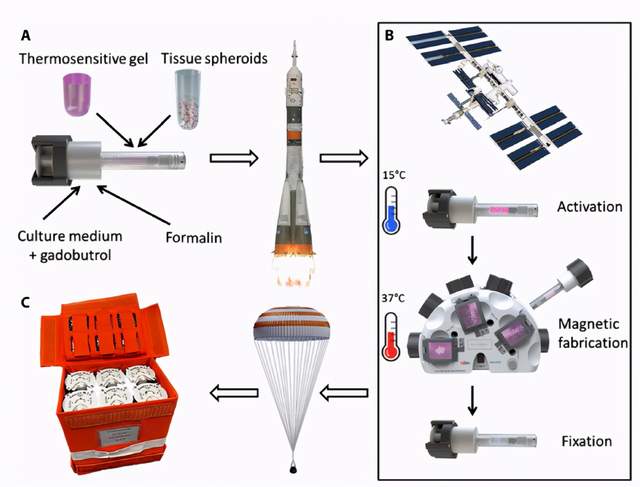
太空实验示意图。A 装有软骨球体的试管 B 在国际空间站上进行实验的主要阶段 C 将试管运送回地球
6. Science Advances: 体内无创3D生物打印
四川大学的Yuwen Chen等人在Science Advances上发表的一篇题为“Noninvasive in vivo 3D bioprinting”的论文中,介绍了基于数字近红外(NIR)光聚合(DNP)的3D打印技术,可实现组织结构的无创体内3D生物打印。从而无需手术植入,就可在体内获得软骨化的个性化耳状组织结构和可修复肌肉组织的载细胞适形支架。这项研究为体内无创3D生物打印的概念提供了证明。
https://doi.org/10.1126/sciadv.aba7406
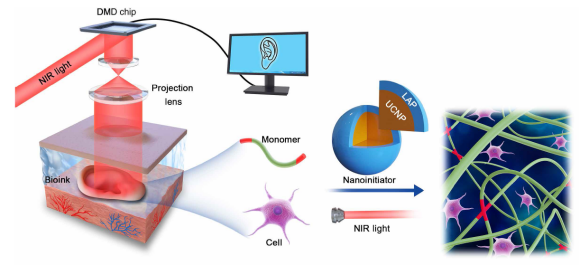
基于DNP的无创3D生物打印的示意图
7. Nature Biomedical Engineering: 活体三维生物打印
意大利帕多瓦大学Nicola Elvassore团队在Nature Biomedical Engineering发表了一篇题为“Intravital three-dimensional bioprinting”的文章,通过使用生物正交双光子环加成法和长于850nm波长的聚合物交联,可将3D载细胞的光敏聚合物水凝胶在活鼠组织间和组织内进行生物打印。类似地,小鼠后肢肌肉上皮的供体肌肉来源的干细胞3D生物打印导致小鼠中肌纤维的从头形成。活体3D生物打印可以作为常规生物打印的体内替代方法。
https://doi.org/10.1038/s41551-020-0568-z
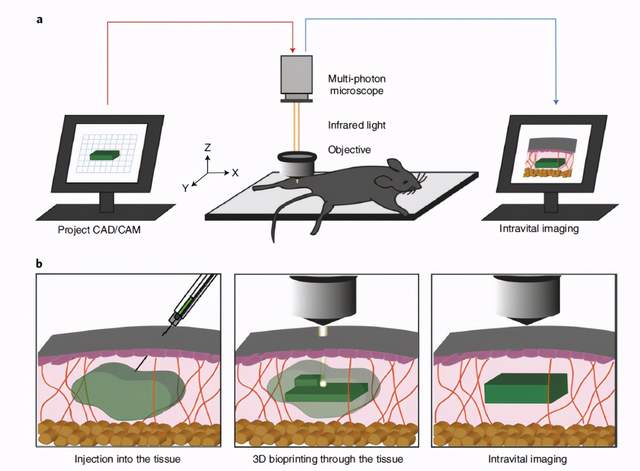
活体3D生物打印设置及体内应用
8. Advanced Materials: 高精度单细胞打印:生物结构的逐细胞制造
来自加州大学的Pengfei Zhang和Adam R. Abate在 Advanced Materials 期刊上发表的题为“High-definition single-cell printing: Cell-by-cell fabrication of biological structures”的文章中,展示了一种高精度单细胞打印的新型微流体技术,可以从多种候选物的混合物中准确打印单个细胞。这款生物打印机采用高度微型化的微流分选机确定性地选择感兴趣的单个细胞进行打印,从而实现约10 µm的精度和约100 Hz的速度。通过选择性的单细胞打印制造具有预定义特征的复杂细胞图案,表明该方法行之有效。该打印机可用于合成具有可控成分和形态的定义明确的球体。这种先进的生物打印方法的速度、准确性和灵活性将使类器官学、组织工程学和空间靶向细胞疗法方面的新研究成为可能。
https://doi.org/10.1002/adma.202005346

HD-SCP打印过程的示意图
HD-SCP依靠微流控喷头将含有细胞的液滴喷射到空气中,随后由荧光激活的分选系统对其进行查询。通过DEP分选器选择具有所需单个细胞的液滴,以打印细胞阵列,细胞图案和定义明确的球体。
9. Nature Communications: 使用植入了表达HIF-1α的干细胞的3D打印水凝胶支架对损伤海绵体进行功能重建
华南理工大学的施雪涛教授和美国俄克拉荷马大学的毛传斌教授领导的研究团队在Nature Communications期刊上发表了题为“Functional reconstruction of injured corpus cavernosa using 3D-printed hydrogel scaffolds seeded with HIF-1α-expressing stem cells”的文章。该研究构建了一种表面有肝素涂层的3D打印水凝胶支架,并向其中植入了缺氧诱导因子(HIF-1α)突变的肌源性干细胞(MDSCs),以制备生物工程血管化海绵体。这种生物工程支架可修复缺损并成功恢复阴茎的勃起和射精功能。这种功能性修复可恢复受伤雄兔的生殖能力,并证明带有血管生成细胞的3D打印水凝胶对阴茎重建具有恢复雄性生殖能力的巨大希望。
https://doi.org/10.1038/s41467-020-16192-x
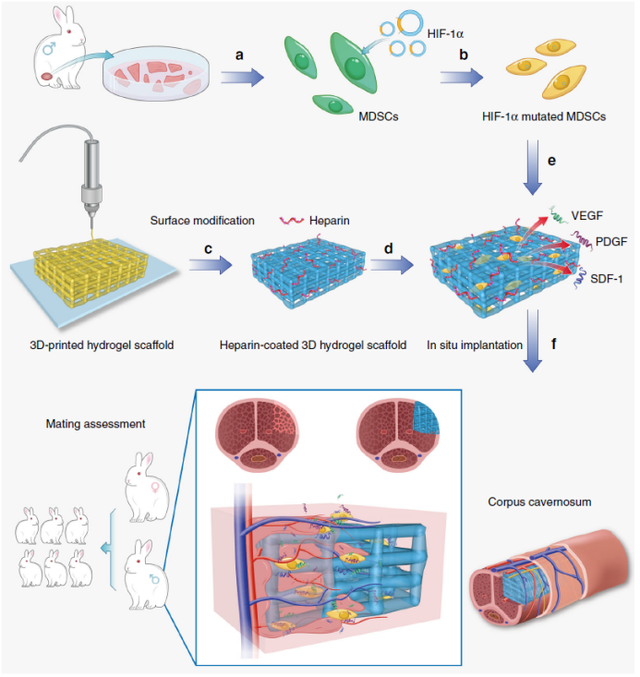
修复兔损伤海绵体的示意图
10. Nature Biomedical Engineering: 用于神经肌肉接口的柔性生物电子植入物的快速成型
来自德累斯顿工业大学的Ivan R. Minev以及圣彼得堡国立大学的Pavel Musienko等在Nature Biomedical Engineering杂志上发表了题为“Rapid prototyping of soft bioelectronic implants for use as neuromuscular interfaces”的文章。研究表明,可以快速打印出柔软的生物相容性材料,以便根据特定的解剖环境、功能和实验模型对定制的电极阵列进行按需原型制作。这些打印的生物电子界面可实现长期集成和功能稳定性。这项技术可使个性化生物电子学应用于神经修复假体。
https://doi.org/10.1038/s41551-020-00615-7
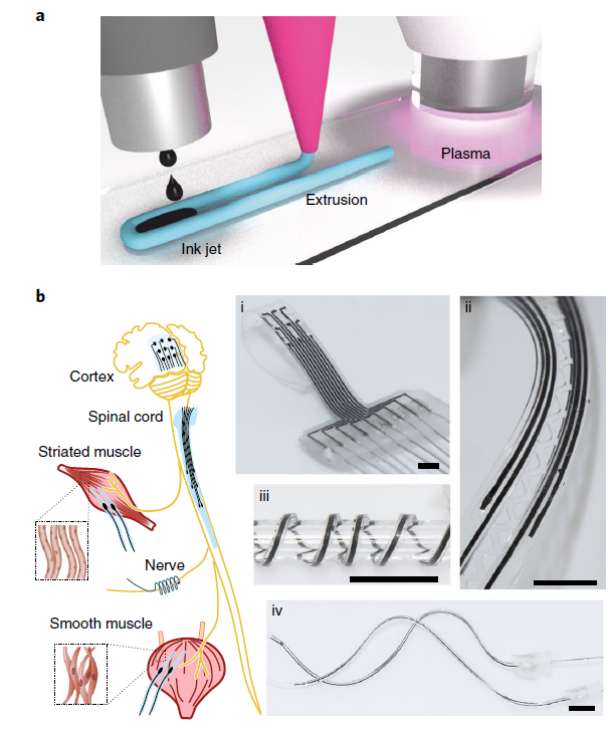
用于连接神经肌肉系统的柔性电极植入物的快速成型
11.《生物设计与制造》发表专刊——“体外组织模型”
哈佛医学院的Yu Shrike Zhang和寺崎生物医学创新研究所(TIBI)的Ali Khademhosseini组织了本期专刊,共收录了10篇优秀的国内外文章来重点关注体外组织/器官模型的构建。其中包含从肿瘤体外模型标题为“Engineering in vitro Human Tissue Models through Bio-Design and Manufacturing”的编者按以及本期的一系列文章中,我们可以了解到通过3D生物打印或基于微流体的器官芯片技术制造的体外组织模型可成为个性化医疗的有力工具。
https://doi.org/10.1007/s42242-020-00080-w
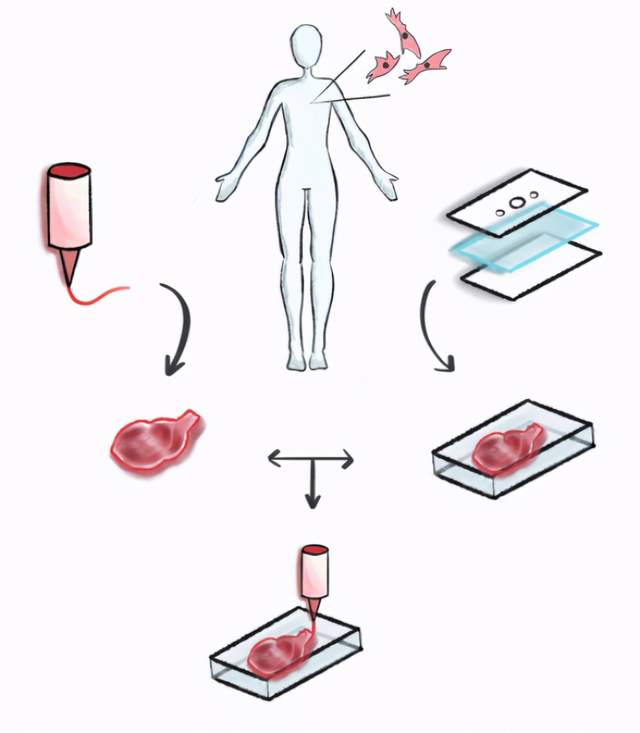
通过生物打印、器官芯片和/或它们的组合来制造体外个性化、基于人体的组织模型
参考文献:
1. Ahn SI, Sei YJ, Park HJ, Kim J, Ryu Y, Choi JJ, Sung HJ, Macdonald TJ, Levey AI, Kim Y (2020) Microengineered human blood-brain barrier platform for understanding nanoparticle transport mechanisms. Nat Commun 11:175. https ://doi.org/10.1038/s4146 7-019-13896 -7
2. Carter CS, Huang SC, Searby CC, Cassaidy B, Miller MJ, Grzesik WJ, Piorczynski TB, Pak TK, Walsh SA, Acevedo M, Zhang Q, Mapuskar KA, Milne GL, Hinton AO Jr, Guo DF, Weiss R, Bradberry K, Taylor EB, Rauckhorst AJ, Dick DW, Akurathi V, Falls-Hubert KC, Wagner BA, Carter WA, Wang K, Norris AW, Rahmouni K, Buettner GR, Hansen JM, Spitz DR, Abel ED, Sheffield VC (2020) Exposure to Static Magnetic and Electric Fields Treats Type 2 Diabetes. Cell Metab 32:1076. https ://doi.org/10.1016/j.cmet.2020.09.012
3. Lawlor KT, Vanslambrouck JM, Higgins JW, Chambon A, Bishard K, Arndt D, Er PX, Wilson SB, Howden SE, Tan KS, Li F, Hale LJ, Shepherd B, Pentoney S, Presnell SC, Chen AE, Little MH (2020) Cellular extrusion bioprinting improves kidney organoid reproducibility and conformation. Nat Mater. https ://doi.org/10.1038/s4156 3-020-00853 -9
4. Brassard JA, Nikolaev M, Hubscher T, Hofer M, Lutolf MP (2021) Recapitulating macro-scale tissue self-organization through organoid bioprinting. Nat Mater 20:22–29. https ://doi.org/10.1038/s4156 3-020-00803 -5
5. Parfenov VA, Khesuani YD, Petrov SV, Karalkin PA, Koudan EV, Nezhurina EK, Pereira FD, Krokhmal AA, Gryadunova AA, Bulanova EA, Vakhrushev IV, Babichenko Ii, Kasyanov V, Petrov OF, Vasiliev MM, Brakke K, Belousov SI, Grigoriev TE, Osidak EO, Rossiyskaya EI, Buravkova LB, Kononenko OD, Demirci U, Mironov VA (2020) Magnetic levitational bioassembly of 3D tissue construct in space. Sci Adv 6:eaba4174. https ://doi.org/10.1126/sciad v.aba41 74
6. Chen Y, Zhang J, Liu X, Wang S, Tao J, Huang Y, Wu W, Li Y, Zhou K, Wei X, Chen S, Li X, Xu X, Cardon L, Qian Z, Gou M (2020) Noninvasive in vivo 3D bioprinting. Sci Adv 6:eaba7406. https ://doi.org/10.1126/sciad v.aba74 06
7. Urciuolo A, Poli I, Brandolino L, Raffa P, Scattolini V, Laterza C, Giobbe GG, Zambaiti E, Selmin G, Magnussen M, Brigo L, De Coppi P, Salmaso S, Giomo M, Elvassore N (2020) Intravital three-dimensional bioprinting. Nat Biomed Eng 4:901–915. https ://doi.org/10.1038/s4155 1-020-0568-z
8. Zhang P, Abate AR (2020) High-definition single-cell printing: cell-by-cell fabrication of biological structures. Adv Mater, p e2005346. https ://doi.org/10.1002/adma.20200 5346
9. An G, Guo F, Liu X, Wang Z, Zhu Y, Fan Y, Xuan C, Li Y, Wu H, Shi X, Mao C (2020) Functional reconstruction of injured corpus cavernosa using 3D-printed hydrogel scaffolds seeded with HIF-1alpha-expressing stem cells. Nat Commun 11:2687. https ://doi.org/10.1038/s4146 7-020-16192 -x
10. Afanasenkau D, Kalinina D, Lyakhovetskii V, Tondera C, Gorsky O, Moosavi S, Pavlova N, Merkulyeva N, Kalueff AV, Minev IR, Musienko P (2020) Rapid prototyping of soft bioelectronic implants for use as neuromuscular interfaces. Nat Biomed Eng 4:1010–1022. https ://doi.org/10.1038/s4155 1-020-00615 -7
11. Zhang YS, Khademhosseini A (2020) Engineering in vitro human tissue models through bio-design and manufacturing. Bio-Des Manuf 3:155–159. https ://doi.org/10.1007/s4224 2-020-00080 -w
全文链接(可点击直接下载PDF)
https://link.springer.com/article/10.1007/s42242-020-00123-2#citeas
关于本刊
Bio-Design and Manufacturing(中文名《生物设计与制造》,简称BDM,浙江大学主办的专业英文季刊,2018年新创,目前已被SCI-E等检索,最新影响因子为4.095。
初审迅速 初审快速退稿(3-4天),不影响作者投其它期刊
审稿速度快 过去两年,平均录用时间约40天,平均退稿时间约10天。注意是平均(非最快的有多快,对个体无意义)。录用后可立即在Springer上线,一般于两周内被SCI-E检索
收稿方向 机械工程(3D打印及生物处理工程等)、生物墨水与配方、组织与器官工程、医学与诊断装置、生物产品设计
期刊主页:
http://www.springer.com/journal/42242
http://www.jzus.zju.edu.cn/(国内可下载全文)
在线投稿地址:
http://www.editorialmanager.com/bdmj/default.aspx
声 明












